
以下文章来源于中国胸心血管外科临床杂志 ,作者尚小珂 等
1 PVAD崛起之路(Hemopump)
1985 年Richard K. Wampler博士成功研发了世界上第一款PVAD 产品—Hemopump(Nimbus公司,美国)(图1),并于1988年开展第1 例临床应用,通过股动脉入路成功为这例心源性休克患者提供了长达46 h的循环支持,而后心功能完全恢复并出院[4]。
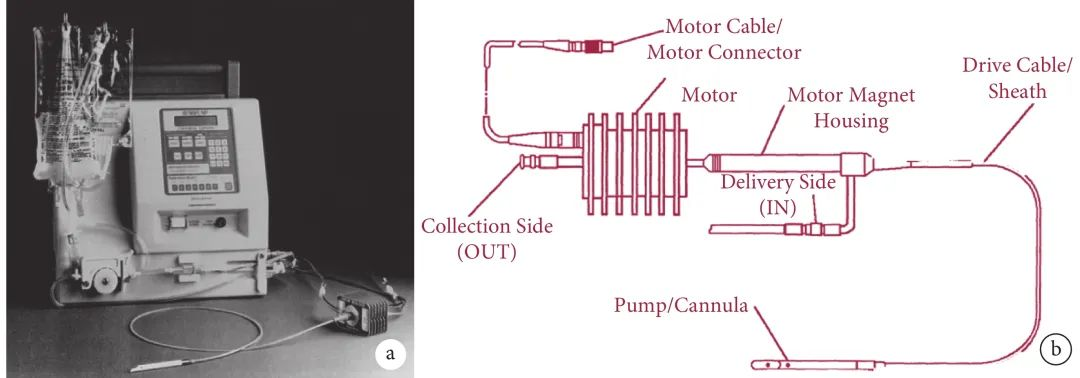
图 1 Hemopump系统[5]
a:Hemopump的控制主机和导管泵外观图;b:导管泵组成部分示意图,由旋转电机、驱动线缆和泵头组成
Hemopump的轴流泵完全参照了水利系统中轴流水泵的设计,通过旋转叶轮使流场产生旋转,再通过导流定子稳定流场(图2)[5]。Hemopump的泵头部分由一个导管和内部的轴流泵组件组成,旋转电机通过包覆鞘管的柔性传动轴将旋转动力传送至泵头处,最终驱动泵头处的轴流泵叶轮实现循环辅助的功能。手术中通过股动脉入路将Hemo-pump的导管泵输送至跨瓣位置,使导管泵远端的开口处位于左心室内,轴流泵部分以及轴流泵近端的流出口位于升主动脉或者主动脉弓内,当轴流泵开始旋转后,轴流泵从远端开口处将心室内的血液通过近端的流出口排入主动脉内,从而实现循环辅助的功能[4, 6]。HemopumpHP31 是一款经胸腔置入的产品,HP21和HP14是经股动脉置入的产品,尺寸分别为24Fr和14Fr。HP21 最宽处的外径为7 mm,最高转速为27 000 转/min,该转速下流量达3.5 L/min。

图 2 Hemopump的轴流泵和轴流水泵[4, 6]
a:Hemopump的轴流泵部分,右侧是旋转叶轮转子,左侧是导流定子;b:轴流水泵的叶轮部分,左侧是旋转叶轮转子,右侧是导流定子
Hemopump辅助左心室功能的主要生理依据是减少左心室前负荷。相较于最早利用氧供氧耗理论且应用最为广泛的循环辅助装置—主动脉内球囊反搏泵(intra-aortic balloon pump,IABP)而言,Hemopump无需依赖心脏自身收缩节律即可主动辅助心脏做功,且有更高的流量,提供更有效的心室减压[5,7]。截至1990 年,Hemopump针对心源性休克的临床试验(Cardiogenic Shock Trial)[8]共完成66 例循环支持,中位数支持时间59.8(1~194) h,其中40例(60.6%)在术中或是导管泵撤出后即刻死亡,26 例(39.4%)成功脱离循环支持辅助, 17 例(25.8%)存活至30 d 随访终点,但所有死亡均与Hemopump无关;且Hemopump在循环辅助中对患者心排血指数(cardiac index,CI)、平均动脉压(mean arterial pressure,MAP)以及左心室做功指数(left ventricular work index,LVWI)均有显著提高。经股动脉Hemopump在第一阶段心源性休克临床试验中共入组145例患者,79%(115/145)成功植入器械,其中40%(46/115)成功脱离循环辅助,且27%(31/115)生存至30 d;急性心肌梗死患者中成功接受和未接受Hemopump辅助的生存率分别为32.4%(11/34)和16.7%(2/12)[5]。Hemopump在血流动力学上的有效性证明可以显著提高心源性休克患者的存活率。另一方面,Hemopump辅助血管成形术的临床试验(supported angioplasty trial)[9]中也显著改善左心室功能,CI平均增加23%(8%~50%),肺毛细血管楔压降低17%(0%~22%),证明即便在心律失常和严重左室功能不全的患者中也能维持稳定和血流动力学提升。虽然获得了临床的成功,但由于Hemopump在临床应用中严重偏离了原始方案,FDA驳回了Nimbus 公司针对Hemo-pump的上市前批准申请(PMA),故无法在美国应用[10]。失败的临床结果也导致了Hemopump被强生公司(美国)收购,在1995 年又被转卖给了美敦力公司(美国)。多次易主也没能阻止Hemopump在商业上的失败。到了新世纪,虽然Hemopump在欧洲仍有临床使用记录,但美敦力还是停止了Hemopump的生产。
虽然Hemopump并未迎来一个成功的结局,但是PVAD 的发展道路却没有止步于此。1995 年来自德国亚琛工业大学Helmholtz 生物医学工程研究所的Thorsten Sieß博士开始对Hemopump进行工程学研究。在早期研究中,Sieß博士提出Hemo-pump的控制器无法提示操作者器械当前所提供的流量是一个重大的缺陷,因为PVAD最主要的功能就是为心功能不足的患者提供额外的流量支持。所以Sieß博士对Hemopump进行了系统性的体外实验和动物实验,来寻找PVAD的流量与心动周期之间的关系[11]。研究结果发现PVAD 的流量在一个心动周期内不是恒定的,它也存在一个周期性的变化,这个变化的趋势与主动脉瓣跨瓣压差的变化基本一致,故基于跨瓣压差建立计算PVAD流量的算法。另外还发现在高档位下PVAD 容易发生抽吸现象(心室容积明显缩小以致呈现心室塌陷现象),此时计算的流量将不再准确,因此PVAD系统除了需要加入流量计算功能还需要对抽吸进行识别和警报[11-12]。
除了无法提供流量的监测,Hemopump另一个技术上的缺陷在于使用了体外电机的方案。由于将驱动电机设计在体外,Hemopump需要1 根1m以上的柔性传动轴将动力传送至体内的轴流泵部分。柔性传动轴的存在会使Hemopump的整个机械结构变得非常复杂。Sieß博士认为如果将驱动电机设计在轴流泵尾部,直接驱动轴流泵,并且和轴流泵一起进入心血管系统,即使用体内电机的方案,可以有效减少由于体外电机传动结构的复杂度带来的风险[11]。
2 PVAD繁荣之路(Impella)
基于Hemopump亟需改进的技术方案,Sieß博士团队开始了新型PVAD 的研究,产品命名为Helm-holtz intravascular pump(图3a)。该产品的最初设计阶段,Sieß博士沿用了Hemopump的轴流泵结构,但创新之处在于采用体内电机并加入流量监测的功能[13]。在体内电机的设计研究中,通过对比测试选定直流无刷(BLDC)电机作为驱动电机,同时在温升度测试中发现最不佳的情况下电机表面的温升也不会超过1.5℃。体内电机在工程样机上的成功和流量算法的建立使Sieß博士团队认为Helm-holtz intravascular pump在技术上具可行;早期6台动物实验的成功(导管泵维持了纤颤动物心脏30 min的必需血流动力学水平)[14]也让他们认为Helmholtz intravascular pump在商业化上具有潜力。因此,Sieß博士于1997 年成立了Impella Cardiotechnik AG公司,推出的第一款产品就是基于Helmholtz intravascular pump工程样机优化而来的双心室辅助系统(图3b)[14],包括用于左心室辅助的Intracardiac Pump LV 6.4 和用于右心室辅助的Intracardiac Pump RV 6.4。
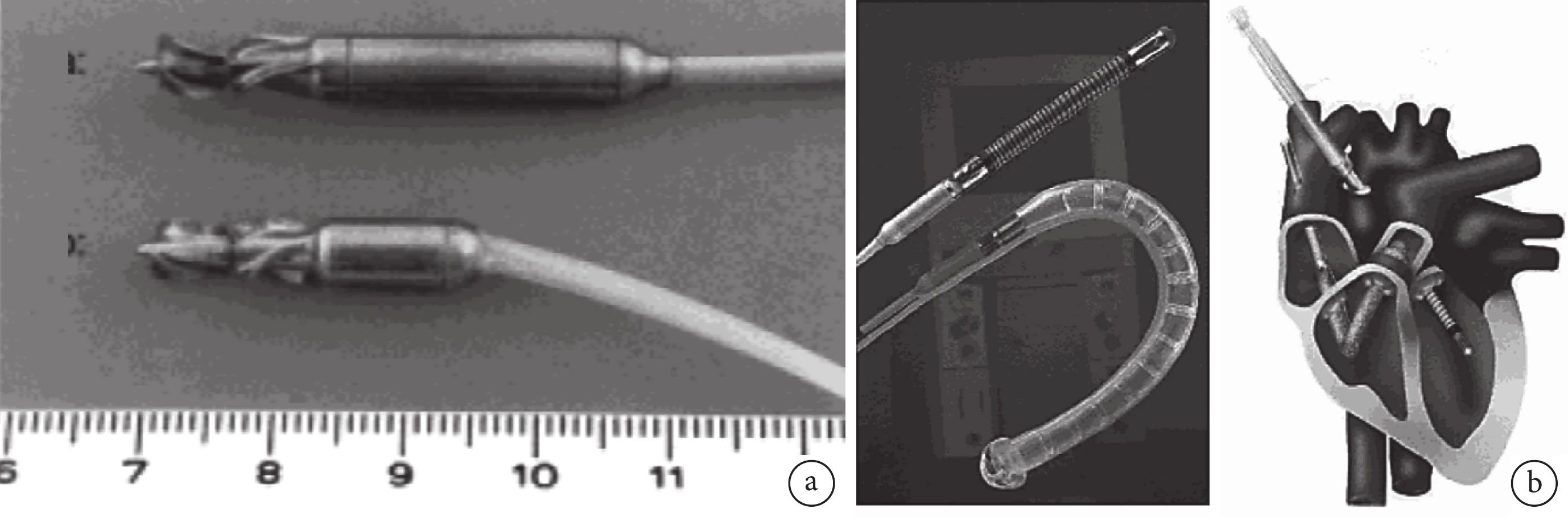
图 3 Helmholtz intravascular pump和双心室辅助系统[14]
a:Helmholtz intravascular pump早期工程样机图,分别为使用直流无刷电机的轴流泵和使用液压马达的轴流泵;b:Impella Cardiotechnik AG第一款产品—双心室辅助系统
Impella Cardiotechnik AG 的第一款产品采用和Hemopump HP31 一样经胸腔升主动脉置入并行改进提升;第二款PVAD 则参考Hemopump HP14 定位为外周介入的产品,但是相比HP14进一步将尺寸从14Fr缩小至12Fr。Impella Cardio-technik AG 12Fr依然沿用了金属的流入和流出窗加一段弹簧加强管构成主要流道的基本结构,最大的区别是用体内电机取代了体外电机[10,15]。
2001年,Impella Cardiotechnik AG的双心辅助系统取得了PVAD 历史上的第一个注册证(欧洲CE认证),随后双心室辅助系统中的Intracardiac Pump LV 6.4更名为Impella LD 与Impella 5.0,分别于2002 年和2003 年取得CE注册证。从公司成立伊始到完成产品商业化,Sieß博士和Impella Cardio-technik AG只用5年时间就取得巨大成功。在实现商业化不久后,Impella Cardiotechnik AG的成功就吸引到美国ABIOMED人工心脏公司的注意。
ABIOMED 最初名为Applied Biomedical 公司,由David M. Lederman博士创立于1981年,从成立之初起就致力于全人工心脏(total artificial heart, TAH)的研制。1987 年ABIOMED上市,发行价为每股11 美金。早期ABIOMED的研发经费主要依赖于美国国立卫生研究院(NIH)提供的人工心脏研究资金和其他私募机构的融资,为了支持TAH巨大的研发投入,ABIOMED 推出了BVS 5000 双心室辅助系统和AB 5000体外循环支持系统用来增加产品销售收入,并且验证可能用在TAH中的关键技术。经过20 年的研发, ABIOMED的第一款TAH—AbioCor,在2001年完成了首例临床植入[16]。AbioCor作为世界上唯一一款采用了无线供电的人工心脏,使ABIOMED 一时声名鹊起。然而,AbioCor由于迟迟无法商业化,以及带来的巨大研发投入和临床支出,使
ABIOMED开始寻求新的盈利增长点。
2005年5 月10 日,诞生了整个心室辅助领域历史上意义最深远的收购案,在ABIOMED 新一代掌门人Michael R. Minogue的带领下,以160万美金的现金和大约403万ABIOMED 普通股的价格收购了Impella Cardiotechnik AG 的全部股份,并将其PVAD 产品统一命名为Impella系列。然而,原有业务的核心产品AbioCor在巨大的投入之下,在2006 年仍然只获得了FDA的人道主义器械豁免(HDE)许可,这使得AbioCor每年的植入量被限制在4 000例以下,且只可应用于其他治疗手段无效的绝症患者[17]。故Minogue开始考虑放弃TAH领域:从商业角度方面,AbioCor在2009—2012 年间没有产生任何的实际销售;从技术角度方面,彼时学术界的态度开始转变,认为与TAH相比,心室辅助对于心力衰竭(心衰)患者可能是更优的治疗选择。且NIH也在渐渐缩减对于TAH项目的资金支持。基于这些原因,Minogue做出自ABIOMED成立以来最大的战略转向,即放弃核心产品AbioCor,并将重心转移至急性心衰领域和导管室应用场景,即Impella产品线。随着重心向Impella转移,ABIOMED原有业务中的AB5000 和BVS5000 也慢慢在缩小份额,且不再研发迭代,而Impella产品的研发投入不断增加,产品线在不断地丰富。因此在2015 年后,ABIOMED只保留了Impella系列产品的销售。
事实验证Minogue决策正确。在ABIOMED战略转向后,营业额从2012 年的1.2 亿美金增长至2022 年的10.3亿美金[18],10年间几乎每年都保持10%~30%的增长率。截至2022年底,Impella系列产品已经成为全球销量最高的心室辅助产品,有超过25 万患者接受过Impella系列产品的治疗。Impella的巨大成功使ABIOMED的股价超过了300美金,大约是其35前年发行价的30倍。
除了商业战略的决策,ABIOMED 在Impella研发和临床上的技术性战略规划也是其巨大成功的关键因素。自2005 年收购Impella Cardiotechnik AG以来,Impella系列产品从最初的3 款(Impella LD、Impella 5.0、Impella 2.5)扩展至如今的10款(图4)[19]。
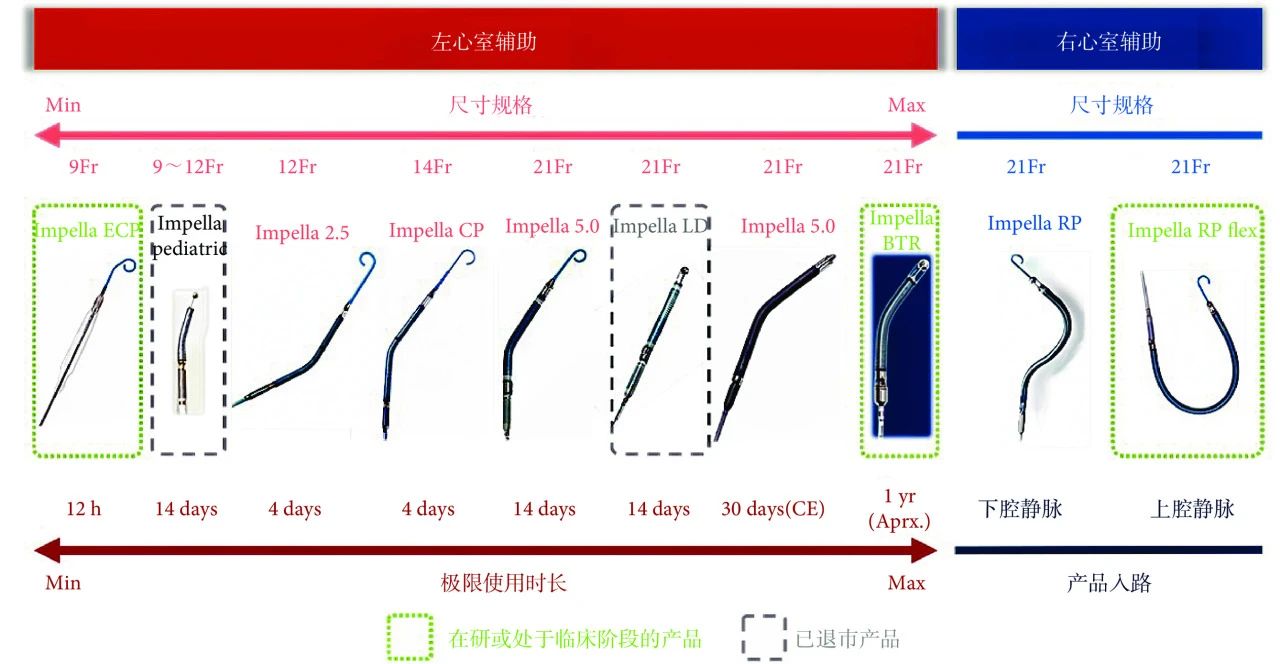
图 4 ABIOMED的Impella系列产品线
从技术性战略的角度来看,ABIOMED 坚持两套技术创新思路:微型化和长期化,即以最核心的产品Impella CP为中心,向导管尺寸进一步缩小和支持时间进一步延长为方向进行技术迭代。Im-pella CP尺寸为14Fr,峰值流量可以达到4 L/min左右,4 d的支持时间虽可以覆盖大部分的心脏急危重症治疗,但是进一步微型化可以满足更多不同心血管状态患者的使用需求。ABIOMED通过研制可扩张鞘将Impella 2.5 的介入尺寸缩小至9Fr。同时体外电机的研发也未停止,在2014 年通过收购ECP Entwicklungsgesellschaft mbH,将其研制的可折叠导管泵并入Impella系列并命名为Impella ECP,该产品成为全球最小的介入式心脏导管泵,直径仅有9Fr,进入主动脉内可扩张,可提供的峰值流量>5 L/min,于2020年完成了首两例植入;2021 年FDA授予Impella ECP “突破性设备”称号,并于2022 年批准开展关键性研究(Impella ECP Pivotal Trial)[20]。在长期化方面,2015年推出的Impella 5.5 将整个系列的支持时间大幅度延长,超过30 d的支持时间(Impella 5.5最长临床使用记录为83 d)将PVAD技术覆盖到以心脏移植前的过渡支持(bridge-to-transplant,BTT)为代表的慢性心衰领域,于2019年通过FDA批准,进一步扩大了产品的适应证[21-22]。随后推出的Impella BTR则彻底将目标瞄准了慢性心衰领域和植入式左心室辅助装置(LVAD)的市场,实现过渡到心脏功能恢复(bridge-to-recovery,BTR),可提供长达1 年的血流动力学支持,已于2022年完成了FDA批准的早期可行性试验的全球首例患者植入[23]。Impella BTR的推出代表着Sieß博士最终实现了他创立Impella Cardiotechnik AG 之初的愿景,即通过对Hemo-pump的改进从而实现将PVAD 技术用于长期的循环支持辅助系统。ABIOMED通过将近20年的技术布局和战略规划,使Impella成为了世界上覆盖患者群体最广、覆盖治疗场景最多的心室辅助系列产品。
从临床应用角度,ABIOMED也在持续推动Impella的临床研究,包括新产品的注册研究和既有产品的拓展研究,旨在进一步提高对既有市场的渗透率。其中最主要的应用是针对高危经皮冠状动脉介入治疗(high risk percutaneous coronary intervention,HRPCI)术中保护和心源性休克(cardiogenic shock,CS)救治。以Impella在HRPCI 中应用的研究证据为例,欧洲注册登记研究(Europella Registry)[24]入组144 例患者,术后30 d死亡率、卒中及血管并发症发生率分别为5.5%、0.7%和4%。FDA 批准的PROTECT系列前瞻性临床研究中,PROTECT Ⅰ单组可行性研究[25]入选20 例HRPCI患者,30 d主要不良心脏事件发生率为20%,未发生主动脉瓣损伤、心脏穿孔和下肢缺血。PROTECT Ⅱ 随机对照研究[26]在452例患者中对比Impella 2.5 和IABP的安全性和有效性,30 d主要不良事件发生率分别为35.1% 和40.1%;90 d结果(40.6% vs. 49.3%)显示Impella 2.5 明显优于IABP。美国注册登记研究(USpella Registry)[27]入组637例患者,比较“真实世界”患者和PROTECT Ⅱ研究中Impella组的差异,得到了相似的研究结果,且院内死亡率有降低的趋势(2.7% vs. 4.6%);分析USpella Registry中127例无保护左主干患者,院内及30 d死亡率分别为1.4%和2.1%[28]。以上研究结果证明Impella 2.5 用于HRPCI术中保护安全有效,FDA于2015 年批准其用于择期或紧急的HRPCI术中的血流动力学支持。
随着技术的更迭和经验积累,以Impella CP为主要手术器械的PROTECTⅢ研究[29]将入组患者中满足PROTECTⅡ入排标准的病例(PROTECTⅢ 组)与原PROTECTⅡ研究的病例(PROTECTⅡ组)相比,虽然年龄更大且冠状动脉疾病解剖更复杂,但结果不仅提高了血运重建的完整性,且院内出血(1.8% vs. 9.3%)、手术低血压(2.2% vs. 10.1%)、心肺复苏或室性心律失常(1.6% vs. 6.9%)发生率明显降低,90 d主要不良事件发生率降低(10.4% vs. 6.9%)。Impella有关肾保护研究[30]还发现Impella可以预防HRPCI 患者术后急性肾损伤,Impella组急性胃损伤发生率(5.2% vs. 27.8%)和HRPCI术后透析率(0.9% vs. 6.1%)明显低于非Impella组,并可缩短住院时间。探索HRPCI 患者术后射血分数提高的研究(RESTORE EF Study)[31]显示90 d 左室射血分数相较基线显著升高(35%±15% vs. 45%± 14%)。新的研究结果验证了Impella可以更有效地降低不良事件发生率,并显著提高射血分数,对于患者的预后有显著的积极效果。目前PROTECT系列已经进入第4阶段(PROTECTⅣ),该研究旨在提供最高水平的科学临床证据(美国心脏协会指南 Ⅰ类推荐),以进一步证明Impella可改善HRPCI 患者预后[32]。ABIOMED通过20多年持续的临床研究投入,希望将Impella打造为HRPCI术中保护的必需手段,且在临床研究中也证明了Impella的临床价值,从而进一步推动Impella在市场的渗透率及在HRPCI 中的使用率。
Impella还可以改善心源性休克患者的血流动力学,其中Impella 2.5、Impella CP、Impella 5.0、 Impella LP在2016年被FDA批准可用于治疗正在进展的心源性休克,如急性心肌梗死后48 h 内或心脏术后的心源性休克;2018 年适应证拓展至心肌病、心肌炎所致的心源性休克。相应的研究证据如ISAR-SHOCK研究[33]是第一个评估Impella治疗急性心肌梗死合并心源性休克(AMI心源性休克)患者可行性的随机对照研究,相比IABP组(13 例), Impella组(12 例)术后30 min CI 增加更显著,但两组30 d总死亡率均为46%。FDA批准的REC-OVER Ⅰ单臂可行性研究[34]入组16 例心脏外科手术后出现心源性休克或低心排血量综合征的患者, Impella 5.0/LD辅助后血流动力学指标即刻提升,出院前93%患者恢复原有心脏功能,且术后30 d、 3个月和1 年生存率分别为94%、81% 和75%,证明Impella进行术后过渡治疗安全可行。USpella Registry研究[35]结果证明AMI心源性休克患者行PCI术前置入Impella比术后置入的院内生存率更高(40.7% vs. 65.1%),但术后两组患者的血流动力学均明显改善。经导管心室辅助(cVAD)国际注册研究[36]也发现早期应用Impella是生存率提高的独立相关因素。IMPRESS研究[37]和ISAR-SHOCK Ⅱ研究[38]结果虽未得出Impella与IABP的差异,但随后的N心源性休克I研究[39]入组171 例AM心源性休克患者,推荐早期放置Impella,30 d生存率可达72%。INOVA-SHOCK 回顾性研究[40]入组204例患者,证明适当使用循环辅助可提高心源性休克患者的生存率,其中2018 年的30 d生存率提高至76.6%。Impella正在进行的大型临床试验如DanGer Shock研究[41-42]已入组360 例患者,将是首个针对Impella能否改善AMI心源性休克患者存活率的充分随机对照试验;RECOVER Ⅳ研究目的是用于评估AMI心源性休克患者PCI前使用Im-pella是否优于不使用[43];STEMI DTU 研究[44]将适应证拓展至ST段抬高型心肌梗死患者,评估PCI术前使用Impella是否可缩小梗死面积并改善预后。这些随机对照研究结果或能更合理地指导Impella的临床使用。
基于充分的临床研究结果,目前为止已有众多国内外指南和专家共识对Impella治疗HRPCI或心源性休克患者制定了相关的推荐意见,如《2015 SCAI/ACC/HFSA/STS心血管病治疗中使用经皮机械循环辅助装置的专家共识》[45]建议复杂的PCI术或严重左心功能不全患者可以根据具体情况使用左心室辅助装置;《中国经皮冠状动脉介入治疗指南(2016)》[46]建议有条件时可选用左心室辅助装置,可降低高危复杂患者PCI死亡率;《急性心肌梗死合并心源性休克的介入治疗AHA科学声明(2021)》[47]认为心衰严重的患者可选择Impella等机械循环辅助装置;《经皮机械循环辅助在复杂心血管疾病介入治疗应用中国专家共识》(2022)[48]推荐循环辅助适用于术前合并严重心血管并发症、复杂高危冠心病患者、术中发生严重病情变化或并发症等情况。研发和临床上的战略性布局都是Impella能成为目前最成功的心室辅助产品的重要原因。随着ABIOMED和Impella的快速发展, PVAD 在最近10年也真正迎来了“崛起”和“繁荣”,更多的企业和产品加入赛道(图5)。强生集团在经历Hemopump的失败后仍在2022 年以高达166亿美金收购ABIOMED,也足以预见Impella和PVAD 赛道的巨大发展潜力和临床价值。
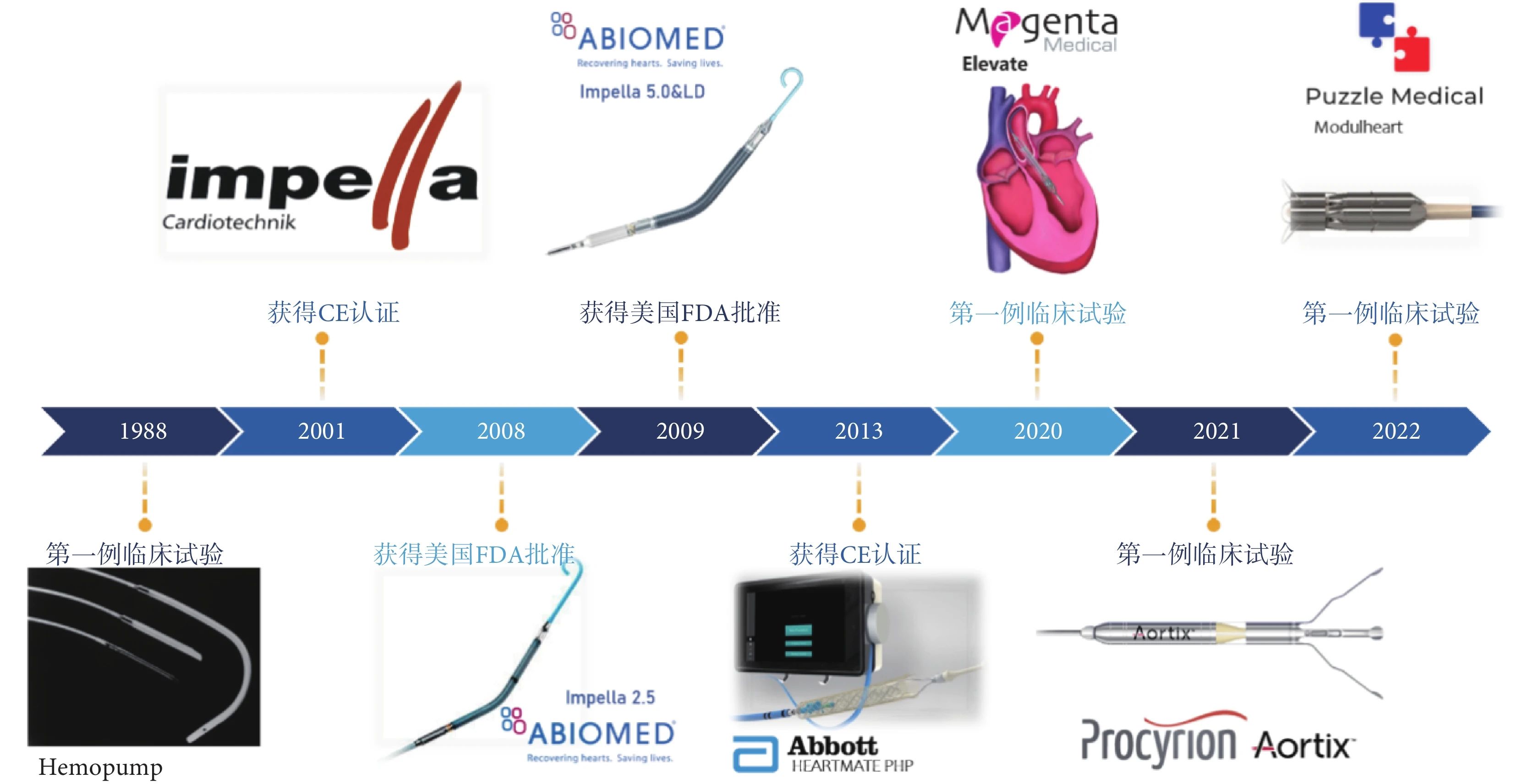
图 5 PVAD 国际市场的发展历史
3 小结与展望
PVAD 从技术路线上主要被分为了体内驱动电机和体外驱动电机。以Impella系列为代表的大多数PVAD 都采用体内电机的技术路线,但是Impella ECP、Heartmate PHP(雅培,美国)、Magenta Elevate (Magenta Medical公司,以色列)为代表仍然采用了体外驱动电机,这是由于体外电机可以将泵头设计成可折叠膨胀结构,从而同时满足小尺寸介入和高流量支持的要求。其中Heartmate PHP虽于2013 年获CE 认证,成为世界上第二款上市销售的PVAD 产品,但其在FDA注册临床试验中发生了8起泵停故障,且直接导致了1例患者死亡,雅培宣布终止该项目,并召回市场上的所有产品。故和Hemopump一样,世界上第三款进入临床的PVAD产品也宣布夭折。Hemopump和Heartmate PHP临床试验的失败及Impella ECP 超长的研发周期表明体外驱动电机可能存在着更高的临床风险和更高的技术障碍。
我国复杂冠心病、急性心肌梗死合并心源性休克、慢性心衰急性失代偿等心血管急危重症病例数量庞大其呈增加趋势,未来对循环辅助的潜在需求量将持续增长。但目前Impella在我国的产品渗透率不高,且高昂的价格也让患者望而却步,我国亟需拥有自主研发的PVAD。如同30 年前Sieß博士对Hemopump的改进一样,国内医疗企业也努力在Impella的基础上进一步提高PVAD 的产品性能、丰富产品功能,运用国产化降低价格,使其能够惠及更多患者群体,为患者提供更好的治疗手段、预后与生活质量。任何一个领域中的科技发展始终是不断攀登, Hemopump开创了PVAD,Impella改变了PVAD,期待国内自主研发的器械可以将PVAD 引领到一个更高的高度。
利益冲突:无。
作者贡献:尚小珂、杨云骢、游辉辉负责撰写初稿;杨夏燕、孙明、吴春林、张雄、王美莹、王雪丽、陈松、张长东、柳梅负责检索文献并核对其准确性;董念国提出研究设想。
参考文献略。
END